8. Sınıf 4. Ünite 1. KONU Periyodik Sistem
🔍 Periyodik Sistem Nedir?
8. sınıf Periyodik sistem, elementlerin artan atom numaralarına ve benzer özelliklerine göre sıralandığı tablodur.

Yazının sonunda bulunan PDF indir butonu ile indirebilirsiniz.
Bu tabloda elementler;
Soldan sağa periyot (satır)
Yukarıdan aşağıya grup (sütun) şeklinde dizilir.
Bu sistem sayesinde elementlerin benzer özellikleri ve tepkime eğilimleri daha kolay anlaşılır.
⏳ Periyodik Sistem Tarihçesi ve Bilim İnsanları
Periyodik tablo bugünkü haline gelmeden önce birçok bilim insanının katkısıyla gelişti. İşte onları kısa ve öz şekilde tanıtalım:
🧑🔬 Johann Döbereiner (1817)
Elementleri üçlü gruplar hâlinde sınıflandırdı
Bu üçlülerde ortadaki elementin özelliği, diğer ikisinin ortalaması gibiydi.
Ama çok az elementi kapsadığı için yaygınlaşmadı.
🧑🔬 Alexander de Chancourtois / Beguyer (1862)
Elementleri artan atom ağırlıklarına göre sarmal (spiral) şekilde sıraladı
Benzer özellikte olanları aynı düşey hatta getirdi
İlk 3 boyutlu sistem önerisidir ama dönemi için anlaşılması zordu
🧑🔬 John Newlands (1864)
Elementleri artan atom kütlelerine göre sıraladı
Her 8. elementin özelliklerinin benzer olduğunu söyledi
Ancak o dönemde bilinen element sayısı az olduğundan sistem tutarlı olmadı
🧑🔬 Dmitri Mendeleyev (1869)
Periyodik sistemin temelini attı
Elementleri artan atom kütlelerine göre sıraladı
Özellikleri benzer olanları aynı sütuna aldı
Eksik olan bazı elementler için yer bıraktı ve özelliklerini tahmin etti
Bu öngörüleri daha sonra doğru çıkınca sistem kabul gördü
🧑🔬 Lothar Meyer (1870)
Mendeleyev ile benzer zamanlarda benzer tabloyu geliştirdi
Atom hacmi ve yoğunluk gibi özellikleri grafikle gösterdi
Ancak Mendeleyev kadar sistematik ve öngörülü değildi
🧑🔬 Henry Moseley (1913)
Günümüzde kullanılan periyodik sistemin temelini attı
Elementleri artan atom numarasına göre sıraladı
Bu sıralama ile elementlerin fiziksel ve kimyasal özellikleri daha tutarlı hale geldi
Modern periyodik sistem onun sayesinde oluşturuldu
🧑🔬 Glenn Seaborg (1940’lar)
Periyodik sisteme aktinit serisini ekledi
Uranyum gibi ağır elementlerin yapısını inceledi
element olan plütonyumu keşfetti
Bugünkü tabloda alt satırda yer alan lantanit ve aktinitler onun çalışmalarıyla ayrıldı
| Bilim İnsanı | Katkısı |
| Döbereiner | Triadlar (3’lü gruplar) |
| Beguye | Spiral periyodik sistem |
| Newlands | Oktavlar kuralı (8’li benzerlik) |
| Mendeleyev | Atom kütlesine göre sıralama, boşluk bırakma |
| Meyer | Benzer sistem ama daha yüzeysel |
| Moseley | Atom numarasına göre sıralama |
| Seaborg | Aktinit serisini ekledi |
📊 Periyodik Tablonun Yapısı ve Özellikleri

Elementler:
Yatay satırlarda → Periyot
Dikey sütunlarda → Grup şeklinde dizilir.
🔢 Periyot ve Grup Sayısı
Toplam 7 periyot (yani 7 yatay sıra) bulunur.
Toplam 18 grup (yani 18 dikey sütun) vardır.
Bu gruplardan:
1A – 8A arası (8 grup): Ana gruplardır
10 tane B grubu (3B – 2B arası): Geçiş metalleri
⚙️ Elementlerin Yerleşimi ve Özellikleri
✅ Periyotlarda (Yatay Satırlarda)
Aynı periyotta bulunan elementlerin:
Katman sayıları aynıdır
(Örneğin: 2. periyottakilerin tümü 2 katmanlıdır)
Sağa doğru gidildikçe:
Proton sayısı (atom numarası) artar
Atom çapı küçülür, elektron sayısı artar
✅ Gruplarda (Dikey Sütunlarda)
Aynı grupta bulunan elementlerin:
Son katmandaki elektron sayıları aynıdır (🔹helyum hariç)
Kimyasal özellikleri benzerdir
Yukarıdan aşağıya inildikçe:
Katman sayısı artar
Atom çapı büyür
Proton sayısı (atom numarası) artar
Periyodik Tabloda bazı gruplardın özel isimleri vardır. Sorularda grup numarası verildiği gibi özel isimleri de sorulabilmektedir. Bunlar:
1A = Alkali Metaller
2A = Toprak Alkali Metalleri
7A = Halojenler
8A = Soygazlar
NOT: Aynı grupta (yukarıdan aşağı) bulunan atomlar benzer özellik gösterir ama kesin değildir. Örneğin 1A’da ilk sırada helyum bulunur ki helyum soygazdır. Helyum gruptaki diğer elementlere benzemez. Diğer gruplarda da istisna durumlar mevcuttur.
Periyodik tabloda atomun yeri nasıl bulunur?

ELEMENTLERİN SINIFLANDIRILMASI
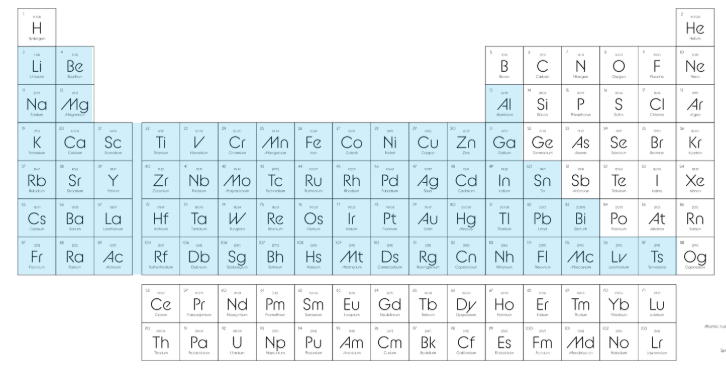
1-) 🔩 METALLER
Periyodik tablonun sol tarafında yer alırlar
B grubu elementleri (geçiş metalleri) de metaldir
Sayıca en fazla olan element grubudur
-
- ⚙️ Metallerin Özellikleri
-
- Isı ve elektriği iyi iletirler
-
- Parlak görünürler
-
- Tel ve levha hâline getirilebilirler
-
- Oda sıcaklığında civa (sıvı) hariç katı haldedirler.
-
- Erime ve kaynama noktaları yüksektir
-
- Elektron vermeye meğillilerdir.
-
- Son katmanlarında genellikle 1, 2 ya da 3 elektron bulunur
🧲 Metallerin Yaygın Kullanım Alanları
İnşaat ve yapı sektöründe (köprüler, demir iskeletler, çelik yapılar)
Elektrik ve elektronik alanında (kablolar, devreler, iletken parçalar)
Ulaşım araçlarında (otomobil, uçak, gemi gövdeleri)
Ev eşyaları ve mutfak gereçlerinde (tencere, tava, çatal, kaşık, musluk)
Kuyumculukta (altın, gümüş, platin takılar)
Ambalaj sanayinde (alüminyum folyo, içecek kutuları)
Sanayi makinelerinde (motor parçaları, pres makineleri)
Silah ve savunma sanayinde (zırh, top, mermi gövdeleri)
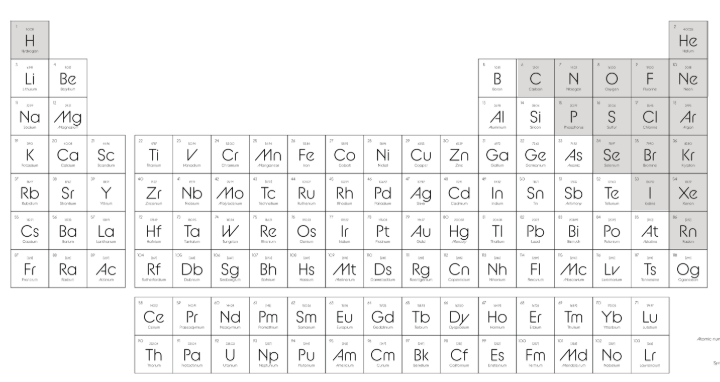
🌫️ 2-) AMETALLER
Periyodik tablonun sağ tarafında yer alırlar
1A grubundaki Hidrojen (H) da ametaldir (ama tabloda en üstte, tek başına durur)
⚙️ Ametallerin Genel Özellikleri
-
- Isı ve elektriği iyi iletmezler (yalıtkanlardır)
-
- Mat görünürler, parlak değillerdir
-
- Tel ve levha hâline gelemezler (kırılgandırlar)
-
- Katı, sıvı veya gaz hâlinde olabilirler
-
- Erime ve kaynama noktaları düşüktür
-
- Oda sıcaklığında genellikle gaz veya katıdırlar
-
- Elektron almaya meğillilerdir.
🌫️ Ametaller Nerelerde Kullanılır?
Solunum ve yanma olaylarında (örneğin oksijen gazı)
Temizlik ürünlerinde ve dezenfektanlarda
Tarım ilaçları ve gübrelerde
Gıda koruyucuları ve su arıtma işlemlerinde
Diş macunu ve ağız bakım ürünlerinde
Sanayide asit üretimi, boya ve plastik üretiminde
Canlıların yapısında (DNA, protein, karbon temelli yapılar)
Elektrik yalıtkanlarında ve izolasyon malzemelerinde
Havacılık, enerji ve patlayıcı üretiminde (hidrojen gibi)
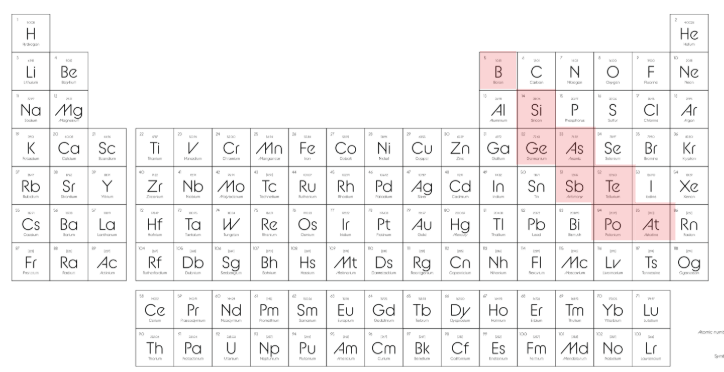
⚖️ 3-) Yarı Metaller
Periyodik tablonun metal ve ametal bölgeleri arasında,
Genellikle basamak çizgisi boyunca (boron – astatin arası) bulunurlar
Hem metal hem ametal özellikleri gösterirler
⚙️ Yarı Metallerin Özellikleri
Fiziksel olarak metallere, kimyasal olarak ametallere benzerler
Isı ve elektriği ametallerden iyi, metallerden kötü iletirler.
Yüzeyleri parlak veya mat olabilir.
Kırılgan değildir ama kırılgan olanları da vardır.
Tel ve levha hâline gelirler
Elektronik ve teknoloji alanında çok kullanılırlar
Oda sıcaklığında tamamı katı haldedir.
⚙️ Yarı Metaller Nerelerde Kullanılır?
💻 Bilgisayar çiplerinde ve mikroişlemcilerde (özellikle silisyum → yarı iletken)
☀️ Güneş panellerinde (elektrik üretimi için)
📱 Elektronik devre kartlarında (transistör, diyot yapımında)
💡 LED, lazer ve optik cihazlarda
🔬 Tıbbi görüntüleme cihazlarında
🧪 Bazı özel cam ve seramik üretiminde
⚡ Enerji teknolojilerinde ve yarı iletken sanayisinde
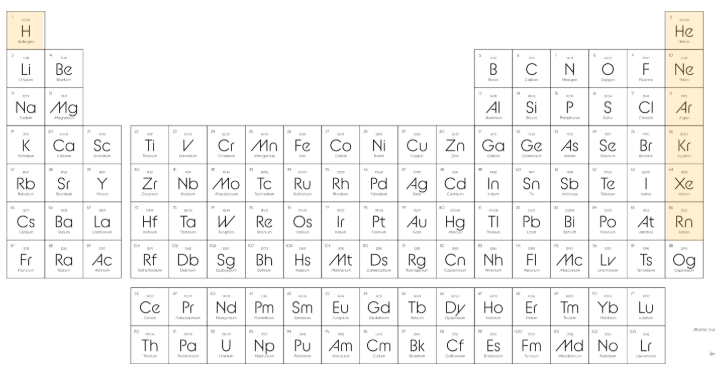
🟣 Soygazlar (Asal Gazlar) (Ametal)
Soygazlar, periyodik tablonun en sağındaki 8A grubunda yer alan elementlerdir.
Kararlı yapıya sahiptirler.
Hepsi birer ametaldir.
Bu gruptaki elementlerin son katmanları doludur → bu yüzden başka elementlerle tepkimeye girmezler.
🧷 Soygazların Genel Özellikleri
Kararlı yapıdadırlar, bileşik oluşturmazlar (istisnalar hariç)
Son katmanları doludur → bu yüzden tepkime vermezler
Ametal grubundandırlar
Oda sıcaklığında gaz hâlindedirler
Elektron almaz, vermez, kararlıdır
Renksiz, kokusuz, tatsızdırlar
Kimyasal tepkimelere karşı tepkisizdirler (inert)
8. Sınıf 2. Konu (Bölüm) Fiziksel ve Kimyasal Değişimler
🧊 Fiziksel Değişim Nedir?
Fiziksel değişim; bir maddenin şekli, görünüşü, hâli veya boyutu değişse de kimyasal yapısının değişmediği olaylardır.
Maddenin tanecik yapısı değişmez
Sadece taneciklerin dizilişi veya aralarındaki mesafe değişir
-
- Genellikle geri döndürülebilir (tersine çevrilebilir)
-
- Hâl değişimi (erime, donma, buharlaşma, yoğuşma, süblimleşme) her zaman fiziksel değişimdir
🧬 Taneciklerde Ne Olur?
Taneciklerin türü değişmez
Yani yeni bir madde oluşmaz
Sadece taneciklerin yeri, düzeni veya hareketi değişir
🎯 Fiziksel Değişime Örnekler
| Olay | Açıklama |
| Buzun erimesi | Katı → sıvı, hâl değişimi var ama su yine su |
| Suyun buharlaşması | Sıvı → gaz, ama hâl değişimi sadece fiziksel |
| Camın kırılması | Şekil değişti ama madde hâlâ cam |
| Kâğıdın yırtılması | Boyutu değişti, yapısı değişmedi |
| Tuzun suda çözünmesi | Tuz molekülleri suya dağılır ama kimyasal yapı aynı |
| Şekere şekil verilmesi | Sadece biçimi değişir |
| Tahtanın kesilmesi | Boyutu küçülür ama tahtadır hâlâ |
| Demirin eritilmesi | Sıvı hale gelir ama demirdir hâlâ |
⚗️ Kimyasal Değişim Nedir?
Kimyasal değişim; bir maddenin tanecik yapısının değiştiği, yeni maddelerin oluştuğu olaylardır. Maddenin kimyasal yapısı değişir. Kimyasal değişimde aynı zamanda fiziksel değişimde olur.
Yeni maddeler ve çoğu zaman farklı özellikler ortaya çıkar
🧬 Taneciklerde Ne Olur?
Atomlar yeniden düzenlenir, bağlar kırılır ve yeni bağlar oluşur
Bu yüzden farklı kimyasal özelliklere sahip yeni maddeler ortaya çıkar
Geriye döndürülemez.
-
- Genellikle ısı, gaz çıkışı, renk değişimi veya koku değişimi gözlemlenir
-
- Geriye döndürülmesi zordur
-
- Maddenin kimyasal bağ yapısı değişmiştir
🔥 Kimyasal Değişime Örnekler
| Olay | Açıklama |
| Odunun yanması | Yeni gazlar ve kül oluşur |
| Demirin paslanması | Yeni bir madde olan demir oksit oluşur |
| Yumurtanın pişmesi | Protein yapısı değişir |
| Sütün ekşimesi | Asitli yapı oluşur |
| Hamurun mayalanması | Gaz çıkışı olur, yapı değişir |
| Elmanın kararması | Havadaki oksijenle tepkimeye girer |
| Betonun donması | Çimento ile su arası yeni bağlar kurulur. |
| Sirke ile karbonatın tepkimesi | Köpürme, gaz çıkışı → kimyasal tepkime |
8. Sınıf 3. KONU (Bölüm) ⚗️ KİMYASAL TEPKİMELER
Kimyasal tepkime, bir veya birden fazla maddenin birleşerek yeni kendi özelliğini kaybedip yeni maddeler (ürün) oluşturduğu olaydır.
🧪 Tepkime Denkleminde Yerleşim:
Giren Maddeler → Tepkimenin sol tarafına yazılır
Oluşan Maddeler (Ürünler) → Tepkimenin sağ tarafına yazılır
İki tarafı → işaretiyle ayırırız.
🔍 Örnek Kimyasal Tepkimeler:
Demir + Kükürt → Demir sülfür
Fe + S → FeS
Karbon + Oksijen → Karbon dioksit
C + O₂ → CO₂
🧬 Kimyasal Tepkimelerde Tanecik Yapısı
Atomlar yeniden dizilir, bağlar kırılır, yeni bağlar kurulur
Yani tanecik yapısı değişir → Bu yüzden yeni maddeler oluşur
Ancak! Bazı özellikler değişmez…
🧠 Unutma: “SUCUK” Kodlaması
Kimyasal tepkime olsa bile şu özellikler korunur, yani değişmez:
S → Atom Sayısı
u
C → Atomun Cinsi
u
K → Toplam Kütle
✔️ Yani: Atomların sayısı, cinsi ve toplam kütle tepkimeden önce ve sonra aynıdır.
👀 Kimyasal Tepkime Olduğunu Gösteren Gözlemler
-
- Renk değişimi
-
- Gaz çıkışı (kabarcık oluşumu)
-
- Koku oluşumu
-
- Isı veya ışık açığa çıkması (yanma gibi)
-
- Çökelti oluşması (iki sıvının birleşip katı oluşturması)
✅ Bu değişimlerden biri veya birkaçı varsa kimyasal tepkime olmuştur diyebiliriz.
🔥 Kimyasal Tepkimelere Örnekler: Yanma tepkimeleri, gıdaların çürümesi, sütün ekşimesi, betonun donması, paslanma, solunum, fotosentez, sindirim, yemeklerin pişirilmesi vb.
NOT: Kimyasal değişimlerin tamamı birer kimyasal tepkime örneğidir.
📊 Tepkime Sürecinde Kütle Değişimi Grafiği
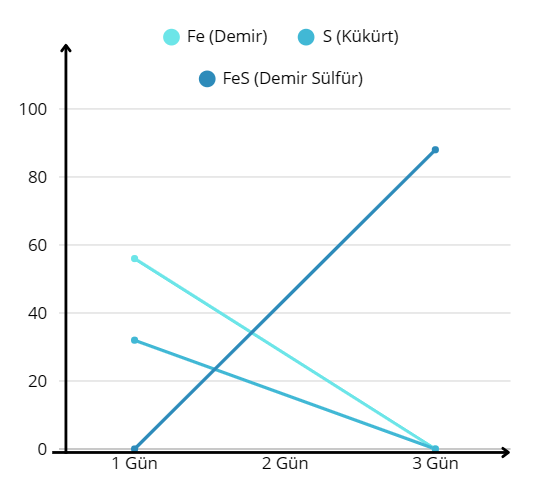
Demir + Kükürt → Demir Sülfür
Fe + S → FeS
Bu tepkimede:
Fe ve S giren maddelerdir
FeS ürün maddedir
Fe: 56 gram, S: 32 gram vermişmiştir. Kimyasal tepkimelerde kütle korunduğu için oluşan üründe yine 88 gramdır.
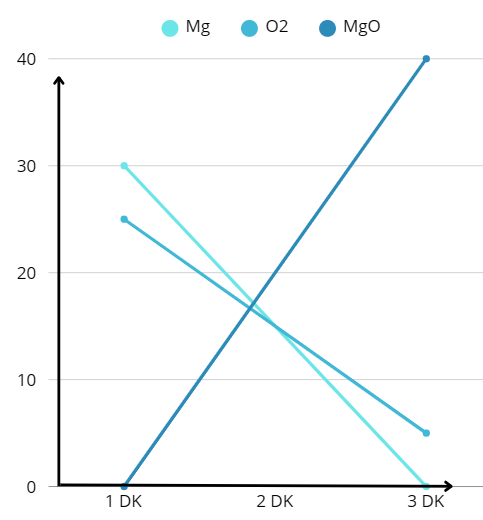
Mg + O₂ → MgO
Mg 30 Gr, O2: 25 Gr
MgO: 50 Gram
Yandaki grafiğe bakıldığında girenlerden Oksijen molekülü 5 gram artmıştır. Yani 5 gram artık madde oluşmuştur.
Girenlerin Kütlesi: 30+25=55 gr
Ürünler: 50 Gram, 5 gramda artık madde yine 55 gram yapıyor.
Artık madde tepkime denklemine yazılmaz.
8. Sınıf 4. Konu (Bölüm) ASİTLER ve BAZLAR
🧪 ASİTLER
Asitler, suda çözündüklerinde ortama H⁺ (hidrojen iyonu) veren maddelerdir.
Bu iyon sayesinde asit özelliği kazanırlar.
⚛️ Suda Çözünerek İyon Vermeleri
Bazı yaygın asitler suda çözündüğünde şu şekilde iyonlaşır:
-
- HCl (Tuz Ruhu) → suda → H⁺ + Cl⁻
-
- H₂SO₄ (Zaç yağı) → suda → 2H⁺ + SO₄²⁻
-
- HNO₃ (Kezzap) → suda → H⁺ + NO₃⁻
✔️ Hepsinde görüldüğü gibi H⁺ iyonu suya geçiyor → bu da asitlik demek!
⚙️ Asitlerin Genel Özellikleri
💧 Suda çözündüklerinde H⁺ iyonu verirler
👅 Ekşi tatlıdırlar (Limon, sirke gibi zayıf asitlerde hissedilir)
🧴 Cildi tahriş eder, dokunmak tehlikelidir
🧼 Metalleri aşındırır, H₂ gazı (Hidrojen gazı) çıkartabilir
🪨 Mermer, kireç taşı gibi maddeleri aşındırır (kalsiyum karbonat içerir)
👕 Kumaşları deler, yıpratır
⚗️ Turnusol kağıdını kırmızıya çevirir
💥 Tepkimelere girerek tuz ve su oluşturabilirler (nötrleşme tepkimesi)
PH değeri 0-7 arasındadır.
🧪 Yaygın Sorulan Asitler (Sınavlık)
HCl → Hidroklorik asit (tuz ruhu, mide asidi)
CH₃COOH → Asetik asit (sirke)
H₂SO₄ → Sülfürik asit (Zaç Yağı)
HNO₃ → Nitrik asit (Kezzap)
CO₂ → Karbon dioksit (suda çözününce karbonik asit – gazlı içecekler)
NOT: Meyvelerin ve yiyeceklerin çoğu asittir. Portakal, limon, yoğurt, üzüm, kiraz, çilek vs.
🧴 BAZLAR
Bazlar, suda çözündüklerinde ortama OH⁻ (hidroksit iyonu) veren maddelerdir.
Bu iyon sayesinde bazik özellik gösterirler.
⚛️ Suda Çözünerek İyon Vermeleri
NaOH (Sodyum hidroksit) → Na⁺ + OH⁻
KOH (Potasyum hidroksit) → K⁺ + OH⁻
Ca(OH)₂ (Kalsiyum hidroksit) → Ca²⁺ + 2OH⁻
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
⚙️ Bazların Genel Özellikleri
💧 Suda çözündüklerinde OH⁻ iyonu verirler
👅 Acımsı tatlıdırlar
🧼 Kaygan ve sabunumsu his verirler
⚠️ Kuvvetli bazlar cildi tahriş ederler, kuvvetli bazlar yakıcıdır
👕 Kumaşları yıpratabilir, renklerini soldurabilir.
⚠️ Cam ve porselenlerin yüzeylerini aşındırır.
📄 Turnusol kağıdını maviye çevirirler
🧪 Asitlerle tepkimeye girerek tuz ve su oluştururlar (nötrleşme tepk.)
PH değeri 7 – 14 arasındadır.
🧴 Yaygın Bazlar (Sınavlık)
NaOH → Sodyum hidroksit (sud kostik)
KOH → Potasyum hidroksit (sabun)
Ca(OH)₂ → Kalsiyum hidroksit (sönmüş kireç)
NH₃ → Amonyak
Mg(OH)₂ → Magnezyum hidroksit
NOT: Temizlik ürünlerinin çoğu bazdır. Deterjani çamaşır suyu, sabun, diş macunu, şampuan, kabartma tozu,
🧪 Örnek Nötrleşme Tepkimesi:
NaOH + HCl → NaCl + H₂O
Baz + Asit → Tuz + Su (Nötrleşme tepkimesi)
Nötrleşme tepkimesinde asit ve bazın pH değerleri önemli değildir.
Asit pH: 4, Baz pH: 8 de olsa bu ikisi tepkimeye girdiğinde nötrleşme olur.
🔍 pH Nedir? (pH Metre)
pH, bir çözeltinin asitlik veya baziklik derecesini gösteren ölçüdür.
pH skalası 0 ile 14 arasında değişir.
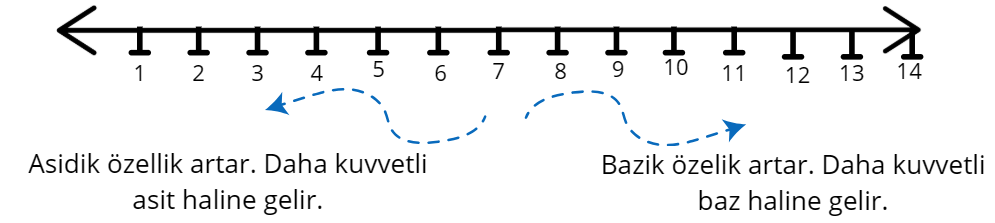
NOT: pH 7 nötrdür. Ne asittir, ne bazdır. Su, tuz, şeker, saf yağlar, alkol vb.
🧪 Belirteç (İndikatör) Nedir?
Belirteçler, maddelerin asit mi, baz mı, yoksa nötr mü olduğunu anlamamıza yarayan renk değiştiren özel maddelerdir.
Sıvıya damlatıldığında veya batırıldığında ortama göre renk değiştirerek uyarı verir.
🎨 Yaygın Belirteçler ve Özellikleri
🔵 Turnusol Kağıdı
Kırmızı turnusol:
Asit → Kırmızı kalır Baz → Maviye döner
Mavi turnusol:
Baz → Mavi kalır Asit → Kırmızıya döner
✅ Genellikle asit-baz ayırımı için en çok kullanılan belirteçtir.
🟠 Metil Oranj
Asit ortamında → Kırmızı Baz ortamında → Sarı
👀 Renk geçişi çok net olduğu için laboratuvarlarda sık kullanılır.
🎀 Fenolftalein
Asit ortamında → Renksiz (şeffaf) Baz ortamında → Pembe
NOT: Örneğin asit mi baz mı olduğu bilinmeyen bir madde kırmızı turnusol kağıdına temas ettirilip renk değişmediği söyleniyorsa bu maddenin kesin asit olduğunu söyleyemeyiz. Çünkü nötr bir madde de olabilir. Nötr maddelere de belirteçler etki yapmaz.
🧪 Doğal Belirteçler:
Bazı doğal maddelerde belirteç görevi görür.
Kırmızı lahana suyu: Doğal belirteçtir.
Asitte → Kırmızı
Bazda → Yeşil-mavi
Çay, zerdeçal, üzüm suyu gibi doğal maddeler de renk değiştirerek belirteç gibi davranabilir.
🌧️ ASİT YAĞMURLARI
Asit yağmuru; havadaki zararlı gazların su buharı ile tepkimeye girip asit oluşturması ve bu asitlerin yağış yoluyla yeryüzüne düşmesidir.
🏭 Asit Yağmuruna Neden Olan Zararlı Gazlar:
-
- SO₂ → Kükürt dioksit
-
- NO₂ → Azot dioksit
-
- CO₂ → Karbondioksit
⚗️ Oluşan Asitler ve Tepkimeleri:
-
- SO₂ + H₂O → H₂SO₄ (sülfürik asit)
-
- NO₂ + H₂O → HNO₃ (nitrik asit)
-
- CO₂ + H₂O → H₂CO₃ (karbonik asit)
✅ Karbonik asit (H₂CO₃) → Normal yağmurda da bulunur ama zayıf asittir.
✅ Ancak fazla CO₂ → Yağmuru daha asidik yapar.
⚖️ Normal Yağmur ve Asit Yağmurunda pH Değeri Nedir?
🌧️ Normal yağmurun pH değeri: Yaklaşık 5.6 (zayıf asidik, çünkü CO₂ zaten doğada vardır)
☠️ Asit yağmurlarında pH: 4.5, hatta 3.0’lara kadar düşebilir!
(Ne kadar düşükse, o kadar tehlikeli!)
🧱 Zararları:
Mermer, kireç ve taş yapıları aşındırır
Toprak verimini düşürür
Göl ve nehirlerin pH’ını düşürerek balıkları öldürür
Bitki köklerine zarar verir
Araç ve bina yüzeylerinde, boyalarda korozyona neden olur
İnsanların solunum sistemini olumsuz etkiler. Cildi tahriş eder.
NOT: Asit yağmurlarnda bazen ayırma hunisi soruları ile zemine mermer, huniye ise baz konmaktadır. Asit yağmurlarındaki sonuçlara ulaşmak için asit kullanılması gerekir. Baz kullanıldığında bu asit yağmurlarına girmez.
8. Sınıf 5. Konu (Bölüm) Maddenin Isı ile Etkileşimi
🌡️ Sıcaklık Nedir?
Bir maddenin taneciklerinin ortalama hareket enerjisidir.
Sembolü: T
Birim: Santigrat derece (°C) ya da Kelvin (K)
Ölçü Aleti: Termometre
Not: Sıcaklık, maddenin ne kadar sıcak olduğunu gösterir ama enerji değildir!
♨️ Isı Nedir?
Sıcaklık farkı nedeniyle bir maddeden diğerine aktarılan enerji miktarıdır.
Sembolü: Q
Birim: Joule (J) veya bazen calori (cal)
Ölçü Aleti: Isı ölçer (kalorimetre)
Not: Isı bir enerji türüdür!
🔄 Isı Transferi (Isının Yönü)
Isı, sıcaklığı yüksek olandan → sıcaklığı düşük olana doğru akar
Bu akış ısıl denge sağlanana kadar devam eder
🔁 Isıl Denge Nedir?
Isı alışverişi sonucunda iki cismin de sıcaklıkları eşitlendiğinde bu duruma ısıl denge denir
Isıl denge sağlandığında:
Maddeler arasında ısı alışverişi durur
Her iki maddenin son sıcaklığı eşit olur
Ortamla birlikte tüm sistemin sıcaklığı aynıdır
Uzun süre aynı ortamda bulunan tüm cisimlerin son sıcaklıkları eşittir.
🔥 Isı Hesaplama Formülü (FORMÜL SINAVDA ÇIKMAZ, SORUMLU DEĞİLİZ.)
Q = m · c · ΔT
📌 Bu formülde ne neyi ifade eder?
Q: Alınan ya da verilen ısı (Joule – J)
m: Maddenin kütlesi (gram – g veya kilogram – kg)
c: Özgül ısı (J/g·°C) → Maddenin 1 gramının sıcaklığını 1°C artırmak için gerekli ısı
ΔT: Sıcaklık farkı (Son sıcaklık – İlk sıcaklık)
Bir maddenin doğrudan ısısı ölçülemez. Ancak alınan verilen ısı enerjisi sorularında kütle, madde cinsi, sıcaklık değişimini bu formül üzerinden yorumlayabilirsiniz.
Örneğin maddeler farklıysa C farklıdır. Kütleler aynıysa ve sıcaklık değişimi eşitse özgül ısısı büyük olan daha fazla enerji depolar gibi.
🌡️ Özgül Isı (Öz Isı) Nedir?
Özgül ısı (veya öz ısı), bir maddenin 1 gramının sıcaklığını 1°C artırmak ya da azaltmak için gereken ısı miktarıdır.
📐 Sembolü: c
🔺 Birim: J/g·°C (Joule / gram · derece)
🧪 Özgül Isı Ne İşe Yarar?
Maddenin ısıya karşı gösterdiği direnci ifade eder.
Her maddenin özgül ısısı farklıdır!
Özgül ısı maddeye özgüdür, miktara bağlı değildir.
Bir maddenin özgül ısısı ne kadar büyükse, sıcaklığını artırmak o kadar zordur (yani daha çok ısı gerekir).
⚖️ Karşılaştırmalı Örnek:
Su → 4.18 J/g·°C
(Yani 1 gram suyu 1°C ısıtmak için 4.18 joule gerekir. Soğutmak için ise suyun bu enerjiyi çevresine vermesi gerekir)
Demir → 0.45 J/g·°C
Buna göre: Demir çok daha çabuk ısınır, su zor ısınır. Demir daha çabuk soğur, su daha geç soğur.
🌡️ SICAKLIK DEĞİŞİMİ NELERE BAĞLIDIR?
1. Maddenin Cinsi
Her maddenin özgül ısı değeri farklıdır. Özgül ısı büyük olan madde daha geç ısınır.
Örnek:
Elimizde 10 gram demir ve 10 gram alüminyum var. İkisini de eşit süre ve özdeş ısıtıcı ile ısıtıyoruz.
Gözlem: Demir daha geç ısınır, alüminyum daha hızlı.
Değişkenler:
-
- Bağımsız değişken: Maddenin cinsi (demir, alüminyum)
-
- Bağımlı değişken: Isınma süresi veya sıcaklık artışı
-
- Kontrol değişkenleri: Kütle (10 g), ısıtıcı gücü, ısıtma süresi
2. Maddenin Kütlesi
Kütle arttıkça, sıcaklığı değiştirmek için daha fazla ısı gerekir.
Örnek:
Aynı cins madde olan suyun 50 gramı ile 100 gramını alıyoruz. Aynı ısıtıcı ile aynı süre ısıtıyoruz.
Gözlem: 50 gram su daha hızlı ısınır.
Değişkenler:
-
- Bağımsız değişken: Maddenin kütlesi (50 g, 100 g)
-
- Bağımlı değişken: Sıcaklık değişimi
-
- Kontrol değişkenleri: Maddenin cinsi (su), ısıtıcı gücü, ısıtma süresi
3. Maddeye Verilen Isı Miktarı
Örnek:
Aynı kütlede suyu alıyoruz, farklı miktarlarda ısı veriyoruz (örneğin 500 J ve 1000 J). (Birisinde bir ısıtıcı, diğerinde iki ısıtıcı) (Birisi büyük ocakta ısıtılıyor, diğeri küçük ocakta ısıtılıyor)
Gözlem: Daha fazla ısı verilen suyun sıcaklığı daha çok artar.
Değişkenler:
-
- Bağımsız değişken: Verilen ısı miktarı
-
- Bağımlı değişken: Sıcaklık artışı
-
- Kontrol değişkenleri: Maddenin cinsi, kütlesi, ısıtma süresi
4. Maddenin Isıtılma Süresi
Örnek:
Aynı cins ve kütledeki maddeyi alıyoruz, birini 2 dakika diğerini 5 dakika ısıtıyoruz.
Gözlem: Daha uzun süre ısıtılan madde daha fazla ısınır.
Değişkenler:
-
- Bağımsız değişken: Isıtılma süresi
-
- Bağımlı değişken: Sıcaklık değişimi
-
- Kontrol değişkenleri: Maddenin cinsi, kütlesi, ısıtıcı gücü
Hal Değişimleri
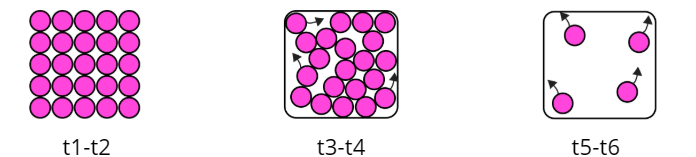
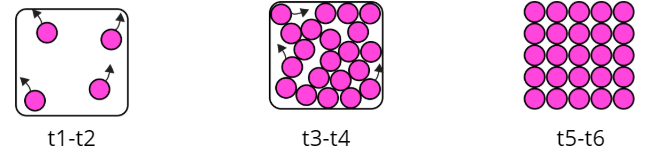
Maddenin üç hali vardır: katı, sıvı ve gaz. Katı maddelerin tanecikleri birbirine çok yakındır ve düzenlidir, belirli şekil ve hacimleri vardır. Sıvılarda tanecikler biraz daha serbesttir, belirli hacimleri vardır ama bulundukları kabın şeklini alırlar. Gazlar ise tanecikleri çok uzak ve düzensizdir, ne şekilleri ne hacimleri bellidir, bulundukları kabı tamamen doldururlar.
Bir madde ısı alarak ya da ısı vererek hal değiştirebilir. Bu değişimlerde maddenin tanecik yapısı değişmez, sadece taneciklerin dizilişi ve hareketliliği değişir.
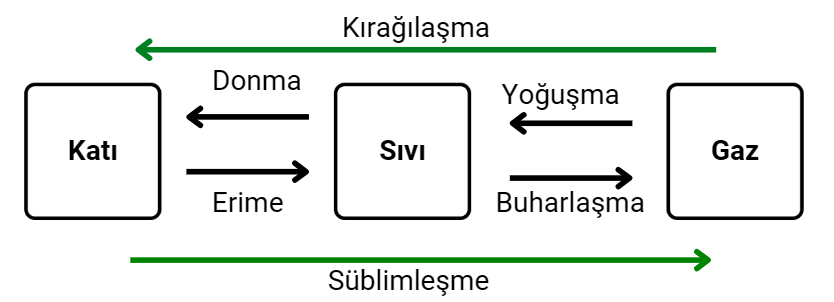
Hal Değişim Süreçleri:
Katı → Sıvı: Erime
Sıvı → Katı: Donma
Sıvı → Gaz: Buharlaşma/Kaynama
Gaz → Sıvı: Yoğunlaşma
Katı → Gaz: Süblimleşme
Gaz → Katı: Kırağılaşma
Bu geçişler sırasında madde ya ısı alır ya da ısı verir. Isı alan maddeler daha hareketli hale geçerken (örneğin katıdan sıvıya), ısı veren maddeler daha düzenli hale geçer (örneğin gazdan sıvıya).
🔥 Erime: Katı bir madde ısı alarak sıvı hale geçer. Sıvı hale geçtiği sıcaklığa erime sıcaklığı denir. Maddenin 1 gramının erimesi için gereken ısıya ise erime ısısı denir.
-
- Tanecikler daha serbest hale gelir.
-
- Örnek: Buzun suya dönüşmesi.
❄️ Donma: Sıvı bir madde ısı vererek katı hale geçer. Katı hale geçtiği sıcaklığa donma sıcaklığı denir. Maddenin 1 gramının donması için gereken ısıya ise donma ısısı denir.
-
- Tanecikler yavaşlar, düzenli hale gelir.
-
- Örnek: Suyun buz olması.
💨 Buharlaşma / Kaynama: Sıvı madde ısı alarak gaz haline geçer. Gaz hale geçtiği sıcaklığa Buharlaşma sıcaklığı denir. Maddenin 1 gramının Buharlaşması için gereken ısıya ise buharlaşma ısısı denir.
-
- Buharlaşma yavaş ve yüzeyde olur, kaynama hızlıdır ve her noktada gerçekleşir.
-
- Örnek: Suyun buhar olması.
🌫️ Yoğunlaşma: Gaz madde ısı vererek sıvı hale geçer. Sıvı hale geçtiği sıcaklığa yoğunlaşma sıcaklığı denir. Maddenin 1 gramının yoğunlaşması için gereken ısıya ise yoğunlaşma ısısı denir.
-
- Tanecikler birbirine yaklaşır.
-
- Örnek: Camın üzerinde su buharının su damlasına dönüşmesi.
🌬️ Süblimleşme: Katı madde ısı alarak direkt gaz hale geçer, sıvı hale uğramaz. Gaz hale geçtiği sıcaklığa süblimleşme sıcaklığı denir. Maddenin 1 gramının süblimleşmesi için gereken ısıya ise süblimleşme ısısı denir.
-
- Örnek: Naftalin buharlaşması, kuru buzun gazlaşması.
❄️ Kırağılaşma: Gaz madde ısı vererek direkt katı hale geçer, sıvı hale uğramaz. Katı hale geçtiği sıcaklığa kırağılaşma sıcaklığı denir. Maddenin 1 gramının kırağılaşması için gereken ısıya ise kırağılaşma ısısı denir.
-
- Tanecikler hızla düzenli hale gelir.
-
- Örnek: Soğuk camda buharın aniden donup buz kristallerine dönüşmesi
🔥 Hal Değiştirme Isıları Nedir?
Bir madde hal değiştirirken sıcaklığı sabit kalır ancak ısı alır veya ısı verir.
Bu alınan ya da verilen ısıya hal değiştirme ısısı denir.
Erime Isısı (Le): 1 gram katı maddenin eriyerek sıvı hale geçmesi için gereken ısı.
Donma Isısı: 1 gram sıvı maddenin donarak katı hale geçerken çevreye verdiği ısı.
Buharlaşma Isısı (Lb): 1 gram sıvının buharlaşması için gereken ısı.
Yoğunlaşma Isısı: 1 gram gazın sıvıya dönüşürken çevreye verdiği ısı.
Süblimleşme / Kırağılaşma Isısı: Katı ↔ Gaz dönüşümleri sırasında alınan ya da verilen ısı.
📊 1) Erime Isısı
| Madde | Erime Isısı (cal/g) |
| Buz (H₂O) | 80 |
| Kurşun | 5 |
| Alüminyum | 95 |
| Kalay | 14 |
| Civa | 2,8 |
🔎 Yorum:
Erime ısısı büyük olan madde, aynı kütlede diğerine göre daha fazla ısı ister → daha geç erir.
Donma da tersidir → Donma ısısı küçük olan madde hemen donar.
💨 2) Buharlaşma Isısı
| Madde | Buharlaşma Isısı (cal/g) |
| Su (H₂O) | 540 |
| Alkol | 204 |
| Aseton | 125 |
| Civa | 59 |
| Eter | 88 |
🔎 Yorum:
Buharlaşma ısısı büyük olan madde aynı kütlede diğerine göre daha geç gaz haline geçer.
Yoğunlaşma da tam tersidir. Yoğunlaşma ısısı küçük olan hemen sıvı hale geçer.
❄️ 3) Donma ve Yoğunlaşma Isıları
Erime ile donma ısısı sayıca eşit, yönce ters olur.
Buharlaşma ile yoğunlaşma ısısı da aynı şekilde.
Örneğin:
Su 1 gramı → 80 cal ile erir → 80 cal vererek donar.
1 gram su → 540 cal ile buharlaşır → 540 cal vererek yoğunlaşır.
Hal Değişim Grafikleri
1-) Isınma Grafiği
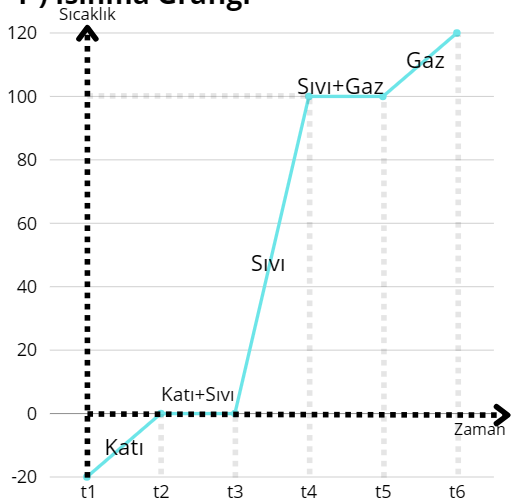
Isınma grafiği maddenin ısı alarak sıcaklığının artması ve hal değiştirmeleri sonucu oluşturulmuştur. Burada:
t1-t2= Katı
t2-t3= Hal değişimi (erime) Katı+Sıvı
t3-t4= Sıvı
t4-t5= Hal değişimi (kaynama) Sıvı+Gaz
t5-t6= Gaz
Hal değişim anlarında maddenin sıcaklığı artmaz. Çünkü gelen ısı hal değişim için kullanılır ve hal değişim gerçekleştikten sonra sıcaklık artmaya devam eder.
NOT: Grafik sorularında t2-t3 veya t4-t5deki gibi düz çizgiler verildiğinde bu anlarda da maddeye ısı verildiğinin bilinmesi gerekiyor. Sıcaklığının artmaması hal değiştirdiğinden dolayı yoksa ısı almaya devam ediyor.
🔥 GÜNLÜK HAYATTAN ISI ALMA ÖRNEKLERİ
🧴 Elimize kolonya döktüğümüzde:
Kolonya hızlıca buharlaşır. Buharlaşmak için ısı gerekir, bu ısıyı elimizden alır. Sonuç: Elimiz serinler hatta hafif üşür gibi olur.
🥵 Terleme:
Vücut ısındığında terler. Ter buharlaşırken deriden ısı alır, bu sayede vücut soğur. Bu, doğal soğutma sistemimizdir.
🧊 Dolaptan çıkarılan soğuk cam şişe
Soğuk cam şişe dışarıdan ısı alır ve içindeki ürün ısınır. Cam şişenin soğuk yüzeyine, sıcak hava temasıyla da yoğunlaşma meydana gelir. Sonuç: yüzey sanki ıslak gibidir → ısı alınmış olur.
🌫️ Kuru buz (katı CO₂) buharlaştığında:
Direkt süblimleşme olur (katıdan gaza) → bu olay sırasında çevreden çok fazla ısı çeker, bu yüzden buz gibi duman çıkar.
2-) Soğuma Grafiği
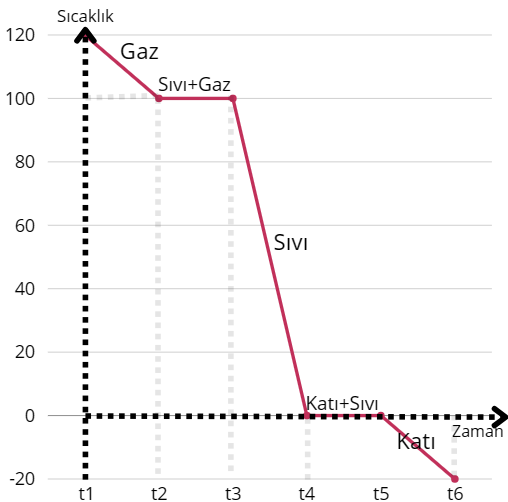
Soğuma grafiği maddenin ısı vermesi ve hal değiştirmesi sonucu oluşturulmuştur.
t1-t2= Gaz
t2-t3= Hal değişimi (yoğunlaşma) sıvı+gaz
t3-t4= Sıvı
t4-t5= Hal değişimi (donma) katı+sıvı
t5-t6= Katı
Madde tüm zamanlarda ısı vermiş ve soğumuştur.
NOT: Grafik sorularında t2-t3 veya t4-t5deki gibi düz çizgiler verildiğinde bu anlarda da maddenin ısı verdiğinin bilinmesi gerekiyor. Sıcaklığının azalmaması hal değiştirdiğinden dolayı yoksa ısı vermeye devam ediyor.
🔥 GÜNLÜK HAYATTA ISI VERME
☕ Sıcak çay bardağı zamanla ılıklaşır
Sıcaklığı çevreye aktarır → çevresine ısı verir → çay soğur.
🧺 Çamaşırların balkonda kuruması (buharlaşma)
Sıvı haldeki su → gaz haline geçerken ısı alır, ama bu buharlaşan su havaya geçerken nemli hava yoğuşursa bu sefer ısı verir (iki yönlü örnek olur).
🌫️ Soğuk havada nefes verirken ağzımızdan buhar çıkması
Nefesimizdeki su buharı, soğuk havada yoğuşarak sıvı hale geçer → ısı verir → bu yüzden dışarıda buhar görünür.
💨 Camın buğulanması kışın içerideki sıcak havadan dolayı olur
İçerideki su buharı → soğuk camda yoğuşur → yoğuşurken ısı verir → buğulanma olur.
8. Sınıf 6. KONU (Bölüm) TÜRKİYE’DE KİMYA ENDÜSTRİSİ
Günlük hayatın her alanında kimya ürünleri var: İlaç, boya, deterjan, gübre, plastik, kozmetik, temizlik malzemeleri vs.
Sanayi ve tarımın temelini oluşturur.
İhracat kalemleri içinde büyük yer tutar → ülke ekonomisine katkı sağlar.
Birçok yan sanayiye ham madde sağlar (örneğin tekstil, inşaat, otomotiv).
🏭 Türkiye’de Kimya Endüstrisinin Kullanım Alanları
-
- İlaç sanayi
-
- Petrokimya (plastik, yakıt, sentetik malzemeler)
-
- Gübre üretimi (tarım)
-
- Temizlik ürünleri (sabun, deterjan, dezenfektan)
-
- Boya ve vernik sanayi
-
- Kozmetik ve kişisel bakım ürünleri
🌍 Bölgelere Göre Kimya Sanayi
Marmara: İlaç, deterjan, kozmetik, plastik (İstanbul, Kocaeli)
Ege: Petrokimya, plastik ham maddesi (İzmir – PETKİM)
İç Anadolu: Gübre, tarım ilacı, rafineri (Kırıkkale, Konya)
Akdeniz: Sabun, temizlik ürünleri, plastik (Adana, Mersin)
Karadeniz: Gıda katkıları, gübre (Samsun)
Doğu Anadolu: Soda, tuz, mineralli ürünler (Van, Erzincan)
Güneydoğu: Asfalt, plastik ve kükürtlü ürünler (Batman, Diyarbakır)
📥 İTHAL ETTİKLERİMİZ
Ham petrol, doğalgaz, Plastik ham maddeleri, Organik kimyasallar, İlaç ve hammaddeleri, Boyar maddeler, Gübre hammaddeleri, Kozmetik hammaddeleri
📤 İHRAÇ ETTİKLERİMİZ
Plastik ürünler (boru, ambalaj), Deterjan, sabun, Kozmetik ürünleri, İlaç ve medikal ürün, Boya ve vernik, Yapıştırıcılar

 LGS Fen Cepte | Fen Bilimleri Özel Ders
LGS Fen Cepte | Fen Bilimleri Özel Ders